| 10 | |
| FA ID | 10 |
| URL | http://leading.lifesciencedb.jp/2-e002 |
| Title | Exploring the supersaturation-dependent life science. |
| Date | 2013-01-29 |
| Author(s) | Yuji Goto |
| Article number | 2, e002 (2013) |
| DOI | 10.7875/leading.author.2.e002 |
| Content | 後藤 祐児 (大阪大学蛋白質研究所 蛋白質構造形成研究室) email:後藤祐児 領域融合レビュー, 2, e002 (2013) DOI: 10.7875/leading.author.2.e002 Yuji Goto: Exploring the supersaturation-dependent life science. 要 約過飽和は自然界にきわめて普遍的な物理化学現象であり,氷や雪,生体における結石,タンパク質をはじめとするさまざまな物質の結晶化から,コンニャクイモのえぐみにまでかかわる.過飽和状態においてなんらかの原因で核が発生すると,過飽和は解消され,溶質は結晶を析出して平衡状態にいたる.タンパク質科学の重要なテーマであるアミロイド線維の形成も,過飽和により支配された原因タンパク質の析出現象であると考えるとわかりやすい.過飽和は決して“ささいな現象”ではなく,広く生命現象を支配する重要な因子であると考えられる.物質科学のさまざまな研究領域において過飽和とその解消に関する研究が行われている.これらと融合することにより,過飽和の解消時にみられるような,生命科学の爆発的な進展が期待できる. はじめに“タンパク質とは何か?”と問われたとき,何と答えるだろうか.筋肉をつくる食物,生体の機能物質,アミノ酸がペプチド結合でつながった鎖状高分子,などなど,それぞれの興味や立場によりさまざまな回答が考えられる.生命科学の歴史においては,タンパク質は(熱や酸により)変性し凝集する生体物質であった(図1).1940年代,中国において独創的なタンパク質研究を展開したWuの論文を読むと,当時,タンパク質の変性は凝集に等しかったことがわかる1)(1995年 再掲載2)).Wuは,水素結合や疎水的相互作用の概念を知らないで,タンパク質の機能構造(ネイティブ構造)は結晶に匹敵する秩序だった構造であると考えた.そして,変性とはネイティブ構造を安定化する相互作用が壊れて不規則な構造となることであり,その結果,タンパク質は凝集すると考えた.これは,タンパク質のネイティブ構造と変性構造の両方の本質をいいあてている.食品としてのタンパク質においては,凝集はタンパク質の本質的な特徴であることを,日々,実感する. 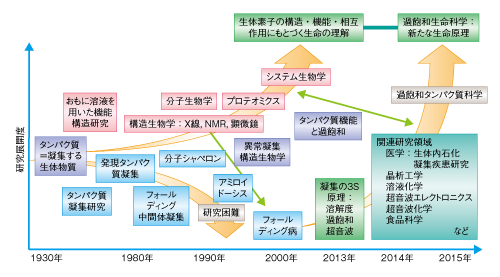 1950年代,ミオグロビン,ヘモグロビン,卵白リゾチームをはじめとするタンパク質のX線結晶構造がつぎつぎと明らかとなり,タンパク質の機能を構造にもとづき理解することがはじまった3).X線結晶解析を直接の研究手段としない研究室においても,吸収や蛍光などの分光学的な手法,あるいは,粘度などの流体力学的な手法を用いてタンパク質の構造が研究された.これらの研究手法のほとんどは“溶液”を必要としたため,凝集やにごりは研究から排除されていった. 大阪大学蛋白質研究所は1958年に設立されたが,筆者の所属する“蛋白質構造形成研究室”のルーツはその設立と同時に発足した3つの研究部門のひとつ“蛋白質溶液学研究部門”にある.名称のとおり,主要な研究対象はタンパク質溶液であった.にごりのないタンパク質溶液を用いることにより,タンパク質の構造と機能の研究が進展したことは疑いない.他方,タンパク質の本質的な特徴である凝集は排除されていき,にごりは実験条件が悪いとみなされるにいたった. 筆者は,1970年代後半からタンパク質研究にかかわってきた.当時,タンパク質の凝集は研究の障害以外なにものでもなかった.1980年ごろ,抗体のドメインのジスルフィド結合を還元しその構造を調べた4-6).還元したタンパク質はしばしば凝集した.凝集の理由ははっきりせず,凝集しないことをつねに願いながら実験を行った.1987年ごろには,“モルテングロビュール状態”とよばれる中間的な状態の構造や安定性を研究した7,8).動的光散乱によりモルテングロビュール状態のサイズを測定しようとしたが,光散乱を測定すると,βラクタマーゼは見る間に大きな凝集体を形成していった.ほかのタンパク質ではモルテングロビュール状態のサイズが報告されているのにβラクタマーゼはにごってしまい測定できない,と嘆いたことがなつかしい. 1.“研究困難”からアミロイド構造生物学へこのような状況は,1990年代に入ると大きく変わっていった(図1).タンパク質研究者は凝集に対峙せざるをえなくなった.大腸菌などに発現させたタンパク質がインクルージョンボディとよばれる凝集体をつくることは無視できなかった9).タンパク質の凝集を防いだりタンパク質のフォールディングを介助したりする別のタンパク質の存在することが明らかになり,分子シャペロンという概念が確立した10-12). ついには,タンパク質研究者は医学の重要なテーマであったアミロイドーシスやその原因物質であるアミロイド線維に注目した.アミロイド線維はβシートを基本構造とする幅10 nm,長さ数μmにも及ぶ細い線維であり,アミロイドーシスと総称されるさまざまな疾患においてアミロイド沈着をひき起こす13-15).アミロイドーシスにはアルツハイマー病,透析アミロイドーシス,アミロイドニューロパチー,II型糖尿病など20種類以上があり,アミロイド線維はこれら疾患の原因物質と考えられている.決定的であったのは,1995年ごろに社会問題をひき起こした感染性ウシ海綿状脳症(BSE)であった16,17).アミロイド線維と共通性をもつタンパク質の異常な凝集体がウシ海綿状脳症をはじめとするプリオン病の感染原因物質であることが示唆された.プリオン病もアミロイドーシスのひとつである.一般に,アミロイドーシスではアミロイド線維が細胞外に沈着するが,パーキンソン病ではαシヌクレインの形成するアミロイド線維と類似した線維状の凝集体が細胞内に沈着する18).アミロイド線維に代表される異常な凝集やミスフォールディングがさまざまな疾患の原因となっていることが明らかになり,フォールディング病,コンフォメーション病,タンパク質異常凝集,などの用語が提唱された14,15).タンパク質の構造物性やフォールディングを研究していた多くの研究者がこれらの研究に参入した. 2000年前後になると,アミロイド構造生物学が台頭した.アミロイド線維やその前駆体,あるいは,そのオリゴマーの構造を研究することにより,凝集の分子機構やアミロイドーシスの発症機構を理解しようとする研究がさかんになった19)(図1).とりわけ,凝集体でも研究を行うことができる固体NMRが威力を発揮した20,21).アミロイドタンパク質のコアと考えられる数残基のペプチドは微結晶を形成し,これがアミロイド構造のモデルとして提唱された19,22).筆者らも,透析アミロイドーシスの原因タンパク質であるβ2ミクログロブリンやアルツハイマー病の原因タンパク質であるアミロイドβタンパク質を研究材料として,溶液NMR 23,24) や蛍光顕微鏡25,26) などを用いた構造生物学的な研究を展開した.これらの研究により,本来は分子の内部でフォールディングしているタンパク質が,変性し分子間でβシートを形成することにより,アミロイド線維を形成しているようすが明らかになってきた(図2). 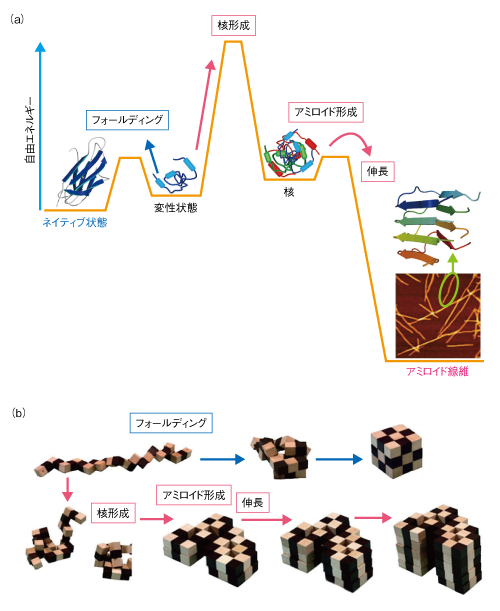 2.アミロイドと結晶との共通点アミロイド線維の構造生物学的な研究と並行して,球状タンパク質のフォールディングと対比される重要な特徴が明らかになった.1960年代,Anfinsenにより,生理的な条件においてネイティブ構造は熱力学的にもっとも安定な構造であることが示された27)(図2).フォールディング反応はしばしば変性状態とネイティブ状態との二状態の転移として協同的に進行する.これに対して,自発的なアミロイド線維の形成は一定の遅延時間ののち突然に起こる.他方,いったんできあがった線維をシードとしてモノマーの溶液にくわえることにより,遅延時間を短縮したりなくしたりすることができる25,28).つまり,核の形成が線維形成の律速となっている. 筆者らは,全反射顕微鏡とアミロイドに特異的な蛍光色素であるチオフラビンTとを組み合わせることにより,アミロイド線維を1線維のレベルで観測する手法を確立した25,29)(図3).この方法により得られた画像は,核形成が伸長反応に比べいかにむずかしいかをよく表わしていた.また,微妙な条件の差により線維の形態はしばしば異なり,これは多型とよばれるが,特定の形態の線維をシーディングにより伝播させることができる30). 図3 アミロイド線維の顕微鏡像 (a)剛直な形状. (b)フレキシブルな形状. アミロイドβ(1-40) の形成したアミロイド線維について,アミロイドに特異的なチオフラビンTの蛍光を全反射蛍光顕微鏡により観察した.微妙な条件の差により異なる形状の線維が観察された. [Download] 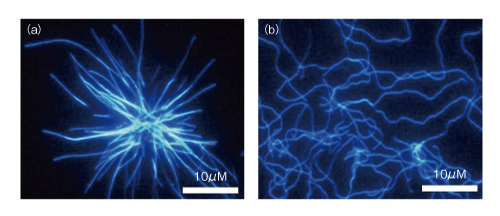 以上のアミロイド線維の形成反応とまったく同様の特徴をもつ現象を思いうかべることができる.すなわち,物質の結晶形成である31,32).三次元に成長した物質の単結晶の形態はアミロイド線維とは大きく異なる.しかし,両者の形成反応の特徴はまったく同じである.アミロイド線維の分子構造あるいは原子構造はわからなくても,その本質は結晶形成と同じであることが想像できた. 物質の結晶は,過飽和状態において核が生じることにより形成される.アミロイド線維も,原因タンパク質の過飽和溶液が解消されたときに析出する構造形態であることが示唆された.プリオン病はタンパク質により伝播する.また,プリオン病には多型(疾患の異なる表現型)がある.とくに,同じアミノ酸配列をもつプリオンタンパク質が原因となるプリオン病にも,宿主や感染経路により多型のあることが示されている17,33).プリオン病の伝播も同じ配列のプリオンタンパク質が示す多型も,ともに不思議なことと考えられているが,プリオンタンパク質が形成する感染性の構造を介して結晶形成と同じ多型や伝播が起こっていると考えると,かなりの部分は直観的に理解できる. 自発的なアミロイド線維の形成は溶液の物理的な条件に大きく依存することが知られている.とくに,溶液を静置すると核形成はなかなか起こらない.静置条件において何カ月もかけて自発的なアミロイド線維の形成を調べた実験もあるが,このような実験の再現性を確認することは容易でない.そこで,自発的なアミロイド線維の形成実験においては溶液をかくはん,あるいは,振とうすることが一般的に行われる.そうすると,静置条件に比べアミロイド線維の形成は確実に速まる.今日では,結晶形成における核形成がかくはんにより促進されることもよく知られている34).これらの点も共通している. 3.超音波によるアミロイド線維の形成溶液のかくはんがアミロイド線維の核形成をひき起こすのであれば,超音波の照射によっても同様の効果が期待できると考えた35).超音波は2万ヘルツ以上の高周波からなる音波であり,各種のセンサー,非破壊検査,殺菌や洗浄などさまざまな用途に利用されている.超音波エレクトロニクスや超音波化学といった研究領域は各種の産業に直結している.水溶液に超音波を照射するとキャビテーションとよばれるミクロの気泡が生じる(図4).これが断熱圧縮されて消滅するとき,高温高圧の環境とともにOHラジカルを生じる.また,キャビテーションは溶液のミクロな流動をひき起こす.ラジカルはさまざまな化学反応をひき起こし,ミクロな流動は溶質に対し,せん断や粒子化など物理的な力を発揮する.アミロイド研究やプリオン研究では超音波の強いアジテーション力を利用してシードを分断し活性なシードの数を増やすことが一般的に行われてきた28).線維の伸長はシードの末端で起こるので,シードを変性させることなく切断することができれば,1回の切断によりシードの活性濃度は2倍になる.プリオンタンパク質の研究においては,DNAを増幅するためのPCR法と同様な,超音波を利用したプリオンシードの増幅が報告されている36). 図4 超音波に依存した化学反応とアミロイド線維に対する効果 [Download] 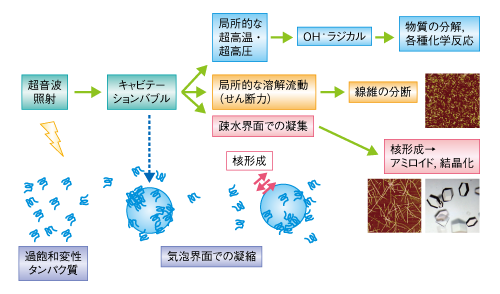 酸変性したβ2ミクログロブリンに対する超音波の照射実験を行った(図5).静置したままでは何も起こらない条件において,水槽型の超音波照射装置を用いてタンパク質溶液に超音波を照射した.そして,アミロイドに特異的なチオフラビンTの蛍光を観察するのとあわせて,光散乱により溶液の状態を観察した.すると,約1時間後,チオフラビンTの蛍光と光散乱の突発的な上昇が観測された.原子間力顕微鏡により生成物を調べると,短いアミロイド線維がたくさんできていた.このようにしてできた短い線維を酸変性β2ミクログロブリンに対し1/10量,超音波を照射しない条件においてくわえたところ,チオフラビンTの蛍光と光散乱はただちに上昇した.つまり,超音波により自発的に形成された短い線維はシードとしての能力をもっていた.以上の実験から,酸変性したモノマーのβ2ミクログロブリンに超音波を照射することによりアミロイド線維が新たに生成することが明らかになった. 図5 超音波によるβ2ミクログロブリンのアミロイド線維の形成35) 酸変性したβ2ミクログロブリン(0.3 mg/ml,0.1 M NaCl,pH 2.5)に対し,水槽型の超音波照射装置を用いて,2万Hzの超音波を1分間の照射,9分間の停止のくり返しで照射した.アミロイドに特異的なチオフラビンTの蛍光を原子間力顕微鏡により観察したところ,約1時間の遅延時間ののちアミロイド線維の形成がはじまったことが明らかになった. [Download] 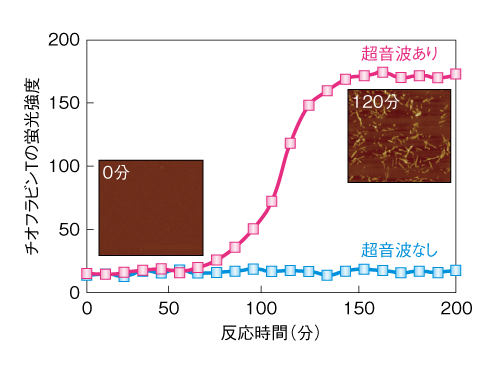 いったん伸長したアミロイド線維に対して超音波の照射をつづけると線維は断片化した28).そこで,線維を誘導する効果と線維を破砕する効果の両方がはたらくと両者がつりあい,より短くて均質なアミロイド線維ができると期待した.実際に,超音波の照射をつづけると約150分子(分子量約200万)のβ2ミクログロブリンから構成される比較的均質なアミロイド微粒子ができあがった37).このようなアミロイド微粒子は水に均質に分散させることが容易である.現在でも,アミロイド線維の構造生物学的な研究は線維が高分子量であるとともに長さが不均一であるため容易ではない.この小さくて均質なアミロイド微粒子は溶液NMRなどタンパク質溶液を対象とした構造物性の研究に有効である38,39). 4.過飽和という新たな視点アミロイド線維形成の本質が原因タンパク質の過飽和条件からの析出であることはまちがいない32).水に溶けた物質(溶質)の溶解度や過飽和は溶液化学の研究対象である.アミロイド線維を理解するには一般的な溶質の過飽和と析出に関する知見を念頭におくことが必要である.溶質の結晶生成をともなう析出現象は溶質の濃度が溶解度をこえたときに起こる.とくに化学工学の分野では晶析とよばれ,物質の分離精製の基本操作である.たとえば,ミョウバンは高温で水によく溶けるが,温度を下げると溶解度は下がり過剰のミョウバンが結晶として析出する. タンパク質でもまったく同様の現象が起こる(図6).ニワトリの卵白リゾチームはpH 4付近で塩が存在しないとよく溶け,未飽和状態(領域1)にある.NaClなどの塩をくわえると溶解度は下がり,平衡論的には溶解度をこえた過剰のリゾチームは結晶として析出する40,41).ただし,溶解度をこえても自発的な核形成の起こらない過飽和条件が存在し,これは準安定状態(領域2)とよばれる.準安定状態で結晶を析出させるにはシードを必要とする.シードにより結晶化が開始すると,溶質の濃度が溶解度に等しくなるまで結晶化は進行し平衡状態となって停止する.塩濃度をさらに高めると自発的な核形成の起こる不安定状態(領域3)が出現する.不安定状態では一定の遅延時間ののち,核が発生し結晶が成長する.さらに過飽和条件が強くなると過飽和を維持することができなくなり,遅延時間をおくことなく核はあちこちで発生する(領域4).大量に発生した核のそれぞれが十分に成長しないうちに溶質の析出は終了してしまい,結果として,結晶ではなく不定形(アモルファス)な凝集が生じる.このようにしてできたタンパク質の不定形凝集は物質が不規則に相互作用して固定化したガラス状態に相当する41).タンパク質の精製に用いられる硫安沈殿は,まさにタンパク質のガラス状態をつくりだしている.以上より,結晶の形成には過飽和が必須であり,過飽和と結晶形成は表裏一体の現象といえる. 図6 過飽和と準安定状態41) (a)ニワトリ卵白リゾチームのpH 5付近における塩濃度に依存した偏比容. (b)β2ミクログロブリンのpH 2における塩濃度に依存した構造状態の相図. 溶質の濃度が平衡溶解度より低いときは未飽和状態(領域1)である.過飽和状態は,自発的な核形成の起こらない準安定状態(領域2)と,遅延時間ののち自発的な核形成へとひきつづく結晶化の起こる不安定状態(領域3)からなる.過飽和度が進みガラス転移点をこえると,ただちに不定形凝集(ガラス状態)を生じる(領域4). [Download] 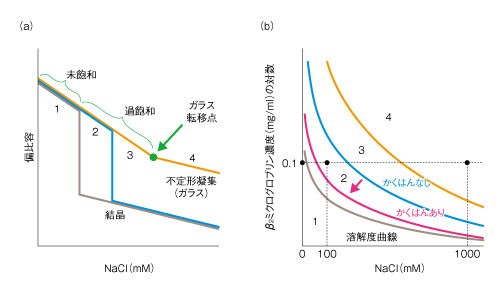 結晶と不定形な凝集,あるいは,ガラス状態の析出は,固体と液体との相転移にもあてはまる.たとえば,水晶は二酸化ケイ素(SiO2)の結晶である.これを高温高圧の条件で溶解させたのち種結晶を使い何カ月もかけてゆっくりと育成すると人工水晶ができる.シーディング実験と同じである.これに対して,溶解させた水晶を短時間で冷却すると不定形な凝集に相当する“ガラス状態”の石英ガラスができる.石英ガラスは遠紫外領域を測定する分光光度計用のセルに使われる.このように,二酸化ケイ素では結晶とガラス状態とを区別して作製することが可能である.他方,窓ガラスなどのガラスは,水晶と同じ二酸化ケイ素を主成分とするが,さまざまな副成分との混合物である.副成分としては,酸化ナトリウム(Na2O),酸化マグネシウム(MgO),酸化カルシウム(CaO)などがある.副成分が存在することにより二酸化ケイ素は結晶に成長することができず,冷却するとただちに“ガラス状態”のガラスになる.また,副成分による吸収のためガラスは遠紫外光を透過しない.今日,アミロイド線維形成のさまざまな阻害剤が開発されているが,それらの多くはアミロイド線維の形成を阻害し不定形な凝集をつくりだす42).このような阻害剤の効果はガラスに含まれる副成分の効果と共通している. 過飽和はきわめて一般的な自然現象であり,さらにさまざまな例をあげることができる.雪や雨は水蒸気の過飽和からはじまる.水の過冷却も代表的な例であり,いったん核ができると氷は成長する.また,ヒトにおいて疾患をひき起こす尿路結石,胆石,痛風などの結石も原因物質の過飽和と一体となっている.尿路結石はシュウ酸カルシウム,胆石はコレステロール,痛風は尿酸の結晶化により起こる.コンニャクイモは生では絶対に食べることはできないが,その原因はコンニャクイモに含まれるシュウ酸カルシウムの針状結晶にある.サトイモの茎であるズイキがピリピリと舌を刺すことがあるが理由はこれと同じである.このように,われわれは過飽和とそれを原動力として生じる物質の結晶化に囲まれて暮らしている. しかしながら筆者は,“低温室で過冷却された高濃度の緩衝液”によりイメージされるように,過飽和はきわめて不安定な状態であり,わずかな物理的な刺激により解消されてしまう,ささいな現象にすぎないと思っていた.このような考えを一変させたのが“エコカイロ”であった32)(図7a).インターネットの検索は,こちらが思いもしないことを回答してくれる.あるとき,“過飽和”で検索すると“エコカイロ”が返ってきた.酢酸ナトリウムの過飽和溶液を利用した簡易ヒーターがエコカイロである.約8 Mの酢酸ナトリウム過飽和溶液は室温ではきわめて安定であり,めったなことで過飽和は解消されない.ところが,過飽和溶液には金属片が入れてあり,これを押してカチッという衝撃をあたえると過飽和は瞬時に解消して結晶の析出がはじまる.約50 mlの酢酸ナトリウム溶液の1箇所に生じた結晶は,数秒のうちに伝播して全体が固体になる.このときの凝固熱を利用して暖をとることができるのである.冷えてカチカチに固まった酢酸ナトリウムは沸騰水で煮ると溶解する.これを放置すると冷えて,はじめの過飽和溶液にもどる. 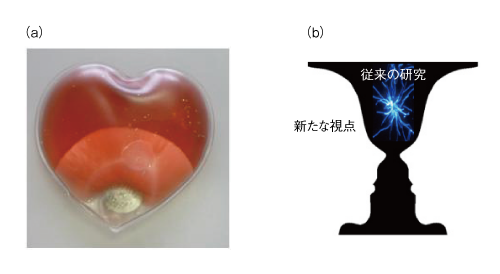 酢酸ナトリウムはさまざまな化合物のなかでもとくに過飽和を形成しやすい物質であり,理科の教材としてもよく使われているらしい.筆者も中学や高校の授業で目にしたことがあったのかもしれない.記憶にないのは興味がなかったからであろう.さっそく購入して実際に体験してみたが,“タンパク質のアミロイド線維形成を解く鍵は,過飽和にあり”と確信した.エコカイロを静置しておくかぎり,過飽和はおそらく永久に解消されない.つまり,準安定状態にある.それがカチッという衝撃により数秒で固化する.あるいは,酢酸ナトリウムのひとかけらをくわえたとき酢酸ナトリウムはそれをシードとして激しい結晶化を開始する.まるで,紙切れにマッチで火をつけることにより,それまで安定に存在していた紙切れが一瞬に燃え切ってしまうイメージである.過飽和は重要である.決してささいなことではない.ルビンの壺が思い出された(図7b).ルビンの壺はデンマークのEdger Rubinという人が1900年代はじめに考案したそうである.いっけん壺であるが,その周辺に注目すると向かい合った人の顔に見える“だまし絵”としてなじみ深い.これまで,アミロイド線維の構造に注目した研究が行われてきた.アミロイド線維の構造は重要であるが,あくまで一面であり,それと同等あるいはそれ以上に重要なのは構造をつくりだす物性である.“溶解度”や“過飽和”に注目することが必要である. 5.アミロイド線維の形成反応の制御自発的なアミロイド線維の形成反応は,かくはんや振とうなどのアジテーションをくわえても時間のかかる再現性の悪い反応であった.超音波の照射は,かくはんや振とうに比べ効果的であるだけでなく操作が簡単である.つまり,対象とするタンパク質溶液を入れた試験管を浴槽につけて超音波を照射することでその効果をみることができる.そこで,アミロイド線維の形成を加速する超音波処理と,多くの試料を一度に測定できるプレートリーダーを合体させることを考えた43).アミロイド線維の形成はチオフラビンTの蛍光を用いるとプレートリーダーにより定量化することができる.実際に市販されているマイクロプレートを用いて実験を行ってみると超音波の効果をはっきりと検出することができた(図8).プレートを固定したままでは照射される超音波の強度やエネルギーは異なるため,プレートの位置によりアミロイド線維の発生までの遅延時間は大きく異なった.そこで,プレートを回転させ照射エネルギーをできるだけ均質化すると遅延時間は同期した.つまり,アミロイド線維の形成は超音波の照射により促進される物理化学反応であった.なお,超音波を照射しないと同じ時間でアミロイド線維はまったく形成されなかった. 図8 超音波によるアミロイド線維の形成43) (a)96ウェルプレートにβ2ミクログロブリンの溶液とチオフラビンTをくわえ,超音波を照射する.チオフラビンTの蛍光強度を観測することによりアミロイド線維の形成を検出する.赤い色で示したウェルでは,アミロイド線維がより速く形成されている. (b)それぞれのウェルにおける蛍光の時間変化. (c)生成されたアミロイド線維の原子間力顕微鏡像. (d)HANABIの外観. (e)HANABIを用いて観測したβ2ミクログロブリンのアミロイド線維形成反応. [Download] 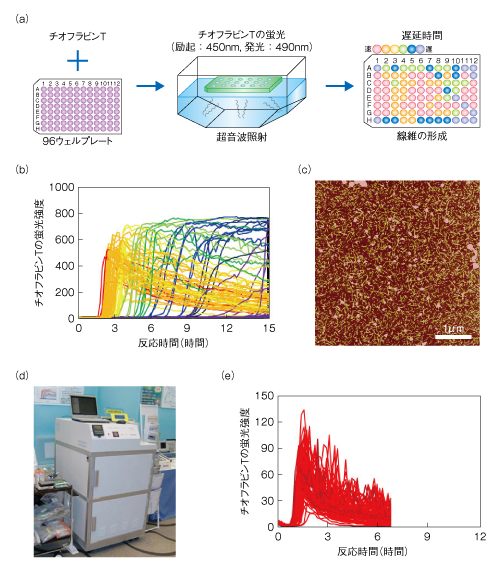 超音波照射装置とプレートリーダーとを合体させることにより,アミロイド線維の形成を自動的に誘導し検出する装置HANABIを開発した(図8).その語源はHANdai Amyloid Burst Inducer(阪大アミロイド爆発誘導装置)である.まるで,打ち上げ花火があがるように,ある一定の遅延時間ののちアミロイド線維の形成を示すチオフラビンTの蛍光強度は急上昇した.たとえば,β2ミクログロブリンを用いたモデル実験では,約1時間に同期させてアミロイド花火を一斉に打ち上げることができた.この装置HANABIは吸収や散乱などの検出もできるので,アミロイド線維だけでなく超音波の照射により加速されるさまざまな現象の観測にも利用できる.これらには,タンパク質のネイティブ状態における結晶化や,アミロイド線維以外のタンパク質の凝集反応も含まれる.とくに機能性タンパク質の凝集は抗体医薬などタンパク質製剤の安定性を評価するうえで重要であり,それらに活用することが期待できる. 6.過飽和の実体と超音波の作用機構過飽和とはいったい何であろうか.準安定状態とは何であろうか.なぜ変性タンパク質はアミロイド線維としてすぐに析出せず過飽和状態に保たれるのであろうか.また,超音波はどのようなしくみにより過飽和を解消するのであろうか.過飽和についてたずねると,“非平衡”“準安定状態”などの用語とともに核形成反応のむずかしさが説明される.核形成をもたらす相互作用はエネルギー的には好ましいが,いくつもの分子を集合させることはエントロピー的に困難であり,きわめてまれにしか起こらない.いったん核が形成されると,そののちの成長は容易であり,核は一気に成長して平衡状態にいたる.このような説明は,タンパク質を含む一般の物質の結晶化だけでなく,アミロイド線維の形成についてもしばしば用いられる.しかしながら,エコカイロの強固な過飽和をみていると,どうしてそんなに核形成がむずかしいのか,別の説明がほしくなる.なぜ酢酸ナトリウムは強固な過飽和溶液をつくるのか,そのしくみはどのくらい理解されているのだろうか. さきにも述べたように,過飽和の代表的な例は水の過冷却である.水が氷になるしくみは物理化学の基本的かつ重要な問題であり精力的な研究がなされてきた44).2002年,氷形成の核がコンピューターにおいて再現された45).氷形成の核とは,いくつかの氷型の水素結合ネットワークが同時に形成された状態であり,きわめて自由エネルギーが高く再現は困難であった.最近では,過冷却水の構造という立場からも研究が進められている46).過冷却水には,偽結晶あるいは成長できない結晶とよんでもよい,より構造化した水の構造があり,これが過冷却水の特異な物性をもたらしているという.つまり,過冷却水の構造それ自体がバルク水と異なっている可能性がある. 以上の水の過冷却に関する議論をみると,過飽和の実体はまったく未解決である32).過飽和は結晶析出の自由エネルギー障壁が高いことにより生じる準安定状態である.溶質にとり自由エネルギー障壁が高いことは相対的な問題である.第1の可能性は,一般的にいわれるように,結晶析出のための核形成の自由エネルギー障壁が高いことである.他方,結晶析出をもたらす因子は,同時にさまざまな構造転移を誘導する可能性がある.これが結晶析出と競合する反応であるならば,それらは溶液状態の自由エネルギーを下げ,ひいては,相対的に溶質の析出をさまたげて,その結果,過飽和となる.別のいい方をすると,デッドエンドプロダクトの安定化である.このようなデッドエンドプロダクトとしては,溶質分子における溶解度を高めるような構造変化のほか,分子間での準安定な相互作用などが考えられる.さきに紹介した過冷却水の構造化した水は46),まさにこのような状態にみえる.さらに想像すると,タンパク質のフォールディングは不溶性の変性タンパク質が溶解性をあげて過飽和になることを追求したために生じたデッドエンドプロダクトにさえみえてしまう. なんといっても知りたいのは過飽和の実体である.もういちど水の過冷却をひきあいにだすと,過冷却現象には,核形成の困難さだけでなく,氷と競争するような水の構造化の起こっている可能性がある.エコカイロには酢酸ナトリウムの結晶化と競争するような構造化した酢酸ナトリウムの水溶液構造が存在しないだろうか.ネイティブなニワトリ卵白リゾチームの過飽和溶液には結晶化と競合するような溶液構造がないだろうか.アミロイド性タンパク質やペプチドの過飽和溶液にはアミロイド析出と競争する溶液構造がないだろうか.しかしながら,筆者が想像するようなデッドエンドプロダクトとしての過飽和状態の実体を明らかにした例はない.結晶化の指標として溶液の伝導度が測定されるが,過飽和においてはモノマー以外のものが存在するようにはみえない.アミロイド研究の分野では細胞毒性をもつオリゴマーの蓄積が注目されているが,過飽和とオリゴマーとの関係についてもよくわからない.ただ,過飽和が進みすぎるとガラス状態が生じる.そこで,ガラス状態とは過飽和状態がそのままトラップされたものとみなすこともできる.もしガラス状態をていねいに調べることができたら,過飽和の実体を明らかにする手がかりが得らえるかもしれない. また,過飽和状態に対する超音波の作用の分子機構を理解することも興味深い問題である.現在,考えられる過飽和の解消をもたらす機構として,超音波がキャビテーション気泡の表面にタンパク質を濃縮し不定形凝集をひき起こしている可能性がある(図4).不定形凝集にアミロイド核がわずかでも含まれていれば,それを核として過飽和は解消されアミロイドは析出する.相図で考えると(図6b),超音波照射により,準安定領域と不安定領域,あるいは,不安定領域とガラス領域との境界線が下側に移動したと考えられる.いずれにしても,超音波の効果は強力でありアミロイド線維の研究の強力な手段となることはまちがいない. 7.過飽和生命科学の開拓これまで,筆者らは,アミロイド線維に興味をもちその構造や形成反応を研究してきた.蛍光顕微鏡や原子間力顕微鏡によりアミロイド線維の形態を調べ,その原子構造および分子構造の解明をめざしてきた23-26).そして,疎水的相互作用や水素結合の重要性,また,シードに依存した形成反応の特徴を明らかにしてきた.このような構造生物学的な研究が重要であることは疑いない. 他方,ルビンの壺(図7b)に象徴されるように,アミロイド線維ができる理由を逆の視点から考えることも重要である.つまり,水に溶けていたタンパク質やペプチドは溶解度の低下した環境では析出する.ところが,実際には容易に析出できないことがしばしばであり,過飽和状態をつくってしまう.そして,過飽和のなかでも準安定状態は意外にも強固であり,通常の条件では解消されない.これが解消されるのは,なんらかの原因により局所的な濃度がさらに高まり,準安定状態が維持できず不安定状態あるいはガラス状態が生じた場合である.過飽和状態の安定性とは関係なく,シードが導入された場合には過飽和は一気に解消する. このような視点にたつと,第1に重要なのは,溶質の濃度と臨界濃度との関係である.タンパク質を例にとりその構造と濃度の相図を示した41,47)(図9).溶質であるタンパク質は溶解度をもつ.タンパク質が大きくても小さくても溶解度より高い濃度においては分子間相互作用が高まりタンパク質は析出する.ネイティブなタンパク質の溶解度は高いのに対し,タンパク質は変性すると溶解度は極端に下がるので,変性はタンパク質の析出をひき起こす.このとき,タンパク質の構造がユニークであればX線結晶解析に用いられるような単結晶を形成する.他方,変性したタンパク質のように構造が多様であれば,溶解度をこえたタンパク質は不定形な凝集体を形成する.しかし,変性したタンパク質でもきわめて短いペプチドは結晶を形成する.アミロイドタンパク質から切り出された数残基のペプチドは微結晶を形成するが,これはアミロイド微結晶としてアミロイド線維のモデルと考えられている19,22).おそらく,一般のアミロイド線維は単結晶と不定形な凝集体とのあいだに位置する.線維のあいだの規則的な相互作用ができず単結晶はできない.それでも,クロスβ構造は維持されることによりアミロイド線維ができる.タンパク質が長くなり相互作用がさらに多様になると,規則的なクロスβ構造もとることができず不定形な凝集体が生じる.そして,相図には過飽和がかぶさる.溶解度をこえても過飽和が存在することにより,相転移はただちには起こらない.準安定状態や不安定状態の存在は析出現象を複雑化する.さらに析出の力が高まると過飽和は維持できずガラス状態が出現する.おそらく,不定形凝集あるいはガラス状態の形成に過飽和は存在しない41). 図9 タンパク質の溶解度と構造状態41,47) (a)タンパク質のサイズと濃度に依存した構造状態の相図. (b)コンフォメーションのユニークさと濃度に依存した構造状態の相図. 溶解度の境界は熱力学的に決定されているが,みかけの溶解度は過飽和により支配されている. [Download] 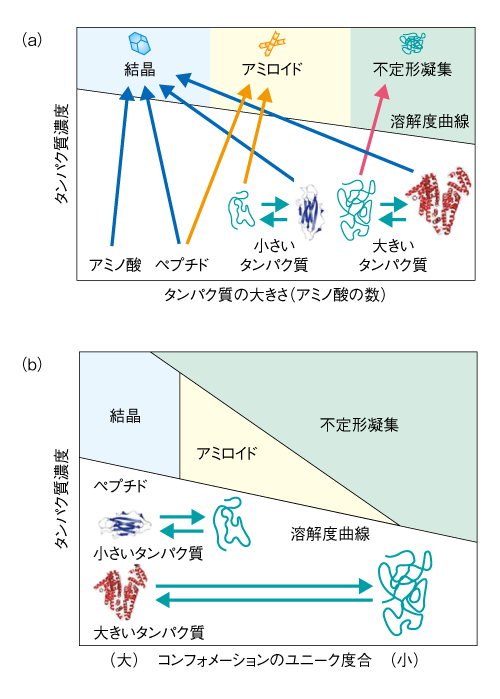 なお,溶解度にもとづくアミロイド線維形成のモデルは,脂肪酸の臨界ミセル濃度とミセル形成によく似ている.ただし,決定的に異なるのは,脂肪酸のミセル形成には過飽和は存在しないことであろう.過飽和は結晶のようにしっかりとした規則的な構造にのみ存在すると考えられる.つまり,規則的な秩序だった結晶には過飽和があるが,不定形凝集にはない,あるいは,きわめて不安定であると予測される. 以上の“溶解度”や“過飽和”にもとづく研究と,アミロイド線維の分子構造および原子構造にもとづく研究とが一体になったとき,ルビンの壺の謎が解明されるであろう. おわりにタンパク質や物質の過飽和現象に注目すると生命科学研究の新たな地平がみえてくる(図1).さきにも述べたように,雨や雪,氷にかぎらず,結晶と名のつくもののまえには必ず過飽和がある.自然界で一般的な過飽和は生体にも深く入りこみ,タンパク質の異常な凝集や結石だけでなく,生命現象全体に大きな影響を及ぼしている可能性がある.もし,過飽和が有利であるとしたら生命は過飽和を活用したであろうし,不利であるならば生命はできるだけそれを回避するかたちで進化してきたであろう.アミロイド線維の形成は生命が過飽和を利用した代表的な例とみなすことができる.過飽和がなければ溶解度をこえたタンパク質やペプチドはただちに析出する.ところが,過飽和により溶液状態は維持される.これは,急激な環境の変化に対し緩衝作用をもたらす分子シャペロンのはたらきに似ている. このほか,生体においてタンパク質のかかわる過飽和現象として,アクチンや微小管など繊維状の高次構造体の形成反応なども考えられる.これらにはさまざまなタンパク質が関与しその形成や分解を制御している.ウイルスの増殖においては,ウイルス核酸をおおうカプシドの形成はカプシドタンパク質単量体や核酸が合成されたのち一気に進行する.この場合にも,カプシドタンパク質単量体の過飽和のかかわっている可能性が高い.過飽和現象の特徴は大きな協同性である.エコカイロからもわかるように,白黒がきわめてはっきりしており,生体のスイッチとして最適である. これまでタンパク質の構造や機能,物性の研究,ひいては,生命科学の研究全体において,“過飽和”という概念はほとんど注目されていなかった.しかし,自然界をみわたすと,過飽和はきわめてありふれた現象である.そして,化学工学における物質の分離精製の領域から,溶液化学における水の過冷却の研究領域,医学における結石の研究領域まで,過飽和を前提とした幅広い研究が行われている.それでも,過飽和の実体はすべての研究領域においてまったく未解決である.過飽和は科学のさまざまな領域を横断する基本的かつ普遍的で本質的な概念である.これを新たな切り口とすることにより,生命科学の爆発的な進展が期待できる. 文 献
参考図書後藤祐児: タンパク質のフォールディングとアミロイド線維形成:タンパク質,昼の顔と夜の顔. 実験医学, 21, 898-902 (2003) Lee, Y. -H. & Goto, Y.: Kinetic intermediates of amyloid fibrillation studied by hydrogen exchange methods with nuclear magnetic resonance. Biochim. Biophys. Acta, 1824, 1307-1323 (2012)[PubMed] 著者プロフィール略歴:1982年 大阪大学大学院理学研究科博士課程 修了,1982年 徳島大学医学部 助手,1984年 大阪大学理学部 助手,1989年 同 助教授を経て,1998年より大阪大学蛋白質研究所 教授. 研究テーマ:タンパク質の構造と機能,物性.過飽和生命科学の開拓をめざす. 研究室URL:http://www.protein.osaka-u.ac.jp/physical/yoeki.html © 2013 後藤 祐児 Licensed under CC 表示 2.1 日本 |
| Content extra | - |
| Category | タンパク質科学 |
| Tags | アミロイド線維, 凝集, 変性タンパク質, 結晶化 |
| Fig1 | 図1 タンパク質研究の歴史と展望 |
| Fig2 | 図2 タンパク質のフォールディングとアミロイド線維の形成 |
| Fig3 | 図3 アミロイド線維の顕微鏡像 |
| Fig4 | 図4 超音波に依存した化学反応とアミロイド線維に対する効果 |
| Fig5 | 図5 超音波によるβ2ミクログロブリンのアミロイド線維の形成 |
| Fig6 | 図6 過飽和と準安定状態 |
| Fig7 | 図7 エコカイロとルビンの壺 |
| Fig8 | 図8 超音波によるアミロイド線維の形成 |
| Fig9 | 図9 タンパク質の溶解度と構造状態 |
| Fig10 | - |
| pdf file | Goto-2.e002-PDF.pdf |
| doc file | Goto-2.e002.doc |
| txt file | Goto-2.e002.txt |