| 4 | |
| FA ID | 4 |
| URL | http://leading.lifesciencedb.jp/1-e004 |
| タイトル | 染色体の接着異常とがん |
| 公開日 | 2012-09-05 |
| 著者 | 丹野悠司・渡邊嘉典 |
| 所属1 | 東京大学分子細胞生物学研究所 |
| 所属2 | 染色体動態研究分野 |
| 巻・ページ・発行年 | 1, e004 (2012) |
| DOI | 10.7875/leading.author.1.e004 |
| レビュー本文 | 丹野悠司・渡邊嘉典 (東京大学分子細胞生物学研究所 染色体動態研究分野) email:丹野悠司,渡邊嘉典 領域融合レビュー, 1, e004 (2012) DOI: 10.7875/leading.author.1.e004 Yuji Tanno & Yoshinori Watanabe: Sister chromatid cohesion defects and cancer. 要 約細胞分裂において複製した染色体を正確に分配することは,個体の発生や生命の次代への継承にとり必須である.異常な分配により生じる染色体数の過不足は,悪性形質の獲得をもたらすと考えられている.多くのがん細胞では染色体不安定性とよばれる高頻度の染色体の分配異常が観察され,この性質が細胞のがん化やがんの悪性化を促進すると考えられている.染色体はS期において複製される際にコヒーシンとよばれるタンパク質により接着され,M期においてコヒーシンが解離することにより分離する.近年,この染色体の接着の制御機構についての理解が急速に進み,染色体の不安定性へとつながる経路についても知見が深まりつつある.ここでは,染色体の接着における制御異常が,がん細胞に広くみられる染色体の分配異常をひき起こす分子機構について解説する. はじめに:染色体の分配異常とがん染色体の分配異常は多くのがん細胞において共通にみられる性質のひとつである.この性質は“染色体不安定性”(chromosomal instability:CIN)とよばれ,染色体不安定性を示す細胞は染色体の数が増えたり減ったりする“異数性”を示す.異数性は,がん遺伝子のコピー数の増加やがん抑制遺伝子のコピー数の減少を介し,細胞のがん化およびがんの悪性化の引き金になると考えられている.がん細胞における異数性は,いまから1世紀以上もまえに観察され,細胞のがん化における重要なステップになるという概念がそのころから提唱されていた1,2).そののち長いあいだ,染色体不安定性のひき起こされる原因は謎につつまれていたが,近年になり,分子レベルでの知見が急速に蓄積しその理解は進展している3).細胞分裂における染色体の分配機構の破綻は染色体不安定性をひき起こすもっとも重大な原因となると考えられている.一般的なヒト培養細胞株における細胞周期は約24時間であるが,このうち,細胞分裂および染色体の分配に要する時間はほんの1時間にもみたない.この短い時間のなかでダイナミックかつ正確に分配される染色体のふるまいを制御する分子機構は非常に精密で巧妙である.分配されるべき姉妹染色分体は,分かれるその瞬間まで互いに接着してペアを形成しており,このペアの形成こそが均等な染色体の分配を保障する鍵となる分子機構である.これまで,この接着の制御機構と染色体不安定性および細胞のがん化との関連はあまり注目されていなかったが,近年の培養細胞および動物個体を用いた研究成果の蓄積により,染色体の接着制御機構の破綻が染色体不安定性をひき起こすことで細胞のがん化を促進するというモデルが提案された.ここでは,均等な染色体の分配を保障する分子機構について解説するとともに,姉妹染色分体の接着制御機構の破綻が微小管と動原体との接続の誤りを介して染色体不安定性の引き金となるというモデルについて解説する. なお,染色体不安定性は,細かくは染色体の数の不安定性(numerical chromosomal instability)と,染色体の構造の不安定性(structural chromosomal instability,遺伝子領域の欠失や重複など)とに分けられるが,ここでは,前者を染色体不安定性として述べる. 1.染色体サイクル細胞が成長し分裂することで増殖するサイクル(細胞周期)があるように,染色体にも倍加と分配というサイクル(染色体サイクル)がある(図1).G1期における1セットの染色体(ヒトの場合には,46本)はS期(DNA合成期)に倍加する.このとき,複製された姉妹染色分体は互いに接着してペアを形成する.そののち,G2期をへてM期(分裂期)に入ると,染色体は分配に適したコンパクトなかたちに凝縮する(図2).このとき,細胞質と染色体とを隔てていた核膜は崩壊し,染色体の運び屋であるスピンドル微小管が染色体をとらえる過程に入る.細胞の両方の極から伸びてきたスピンドル微小管は,姉妹染色分体のそれぞれに形成される動原体に反対の方向から接続し,張力のバランスにより染色体は細胞の赤道面に並ぶ.すべての染色体が整列をおえると,姉妹染色分体のあいだの接着は解かれ,スピンドル微小管により1セットずつ反対の方向へと引っ張られていく.これにともない細胞質が分裂し,均等な染色体数,すなわち,同じ遺伝情報をもつ2つの娘細胞が生じる.分離ののち染色体は脱凝縮し,核膜がそれをとりかこむことで再び核が形成される.このようなサイクルをつうじて染色体は倍加し均等に分配される. 図1 染色体サイクル G1期の染色体は,S期(DNA合成期)に複製され姉妹染色分体ペアを形成する.G2期をへてM期(分裂期)に進むと染色体は凝縮する.そののち,細胞の両極にある中心体から伸びるスピンドル微小管が姉妹動原体を反対の方向からとらえて引っ張ることで,姉妹染色分体ペアが整列する(M期中期).すべての姉妹染色分体が整列するとペアは分離し(M期後期),2つの娘細胞へと分配されたのち細胞質分裂が起こり,細胞は再びG1期へと進む.染色体の分配に異常が生じ染色体数の過不足が起こると,細胞のがん化やがんの悪性化がひき起こされると考えられる. [Download]  図2 M期における染色体の動態 間期からM期前期へと進行する際に染色体(青色)の凝縮とともに核膜の崩壊が起こる.M期前中期においては染色体の姉妹動原体(赤色)をスピンドル微小管(緑色)がとらえて染色体の整列がはじまる.M期中期においてすべての染色体が整列をおえると,M期後期への進行が起こり染色体ペアは分離し分配される.染色体の分配がおわると同時に細胞質分裂が起こり2つの娘細胞が生じる.その際に染色体は脱凝縮し再び核が形成される.染色体の接着は姉妹動原体が反対の方向からとらえられる際に張力を生み出す役割をもつ.これは染色体の整列のため必須であり,接着の失われた染色体は正しく整列できない. [Download] 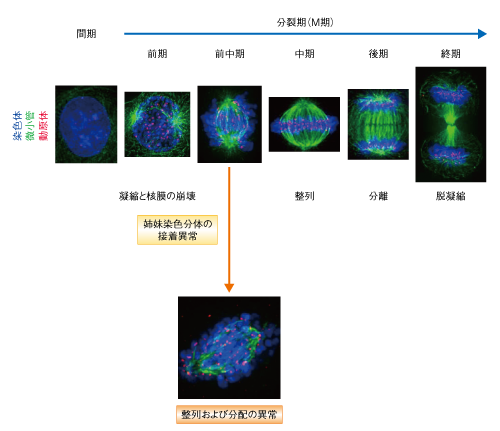 2.姉妹染色分体の接着の制御機構複製されてから分離の瞬間まで,姉妹染色分体はどのように接着しているのだろうか? この問いに対する答えは,コヒーシン(cohesin)とよばれるタンパク質の発見によりもたらされた4).コヒーシンはSmc1,Smc3,Scc1,SAの4つのサブユニットからなるリング状の構造を形成し(図3a),姉妹染色分体をとりかこむかたちでその接着を確立すると考えられている5).コヒーシンによる接着は染色体の全長にわたり確立されるが,脊椎動物の細胞ではM期へと進行する際に染色体の腕部における接着の多くは解消される6)(図3b).これは,染色体の腕部に存在するコヒーシンSAサブユニットがキナーゼPlk1によりリン酸化されることに起因している.リン酸化されたコヒーシンはWaplとよばれるタンパク質のはたらきにより染色体からはずれることが知られているが,Waplがどのようにしてリン酸化したコヒーシンの解離を促進するのかについては未解明の点が多い.染色体の腕部におけるコヒーシンの除去の生理的な意義は,姉妹染色分体の接着をあらかじめ部分的に解除しておくことにより,のちに完全に分離させる際の効率を高めることであると考えられている. 図3 姉妹染色分体の接着 (a)コヒーシンの構造.Smc1,Smc3,Scc1(Rad21),SA(SA1,SA2)の4つのサブユニットからなり,リング状の構造をとる.このリング構造により束ねられるように姉妹染色分体ペアは接着するというモデルが提唱されている. (b)M期キナーゼPlk1によるコヒーシン(SAサブユニット)のリン酸化(P)は,Waplを介し染色体の腕部におけるコヒーシンの解離を促進する.シュゴシンはホスファターゼPP2Aと協調してPlk1に拮抗し,セントロメアにおける染色体の接着を保護する.セントロメアにおける接着の維持は,姉妹染色分体のあいだにおける張力の発生および染色体の整列に必須の役割をもつ. [Download]  このとき,染色体のセントロメアとよばれる部位においてはコヒーシンが除去機構をまぬがれ接着が維持される.これは,シュゴシン(Shugoshin)とよばれるタンパク質のはたらきによる7).シュゴシンは,ホスファターゼPP2Aと複合体を形成しセントロメアに局在することで,コヒーシンをリン酸化から保護しWaplによる除去機構に拮抗すると考えられている.ヒトにおいては2つのパラログが見い出されており,それぞれSgo1,Sgo2と名づけられている.体細胞分裂においてはSgo1が姉妹染色分体の接着に主要な役割を担うが,Sgo2もPP2Aの局在化の促進をつうじ接着の維持に寄与すると考えられている7,8).シュゴシンによる保護機構により維持されるセントロメアにおける接着は,姉妹染色分体がスピンドル微小管により反対方向に引っ張られる際に張力を生み出し,これにより染色体の整列は可能となる.コヒーシンやシュゴシンを不活性化した場合など染色体の接着を解消してしまうような状況では,姉妹染色分体は整列することができず細胞内に散らばってしまい,細胞は正常に染色体を分配することができない.セントロメアにおける接着が維持されることですべての染色体が細胞の赤道面に並ぶと,これを監視するスピンドルチェックポイント機構が解除される.その結果,ユビキチンリガーゼ複合体であるAPC/C(anaphase promoting complex/cyclosome)が活性化し,サイクリンBおよびセキュリン(securin)の分解が起こる.とくに,セキュリンはコヒーシンの切断を担うセパラーゼの阻害タンパク質であり,その分解はセパラーゼの活性化にともなうコヒーシンの切断を促進し姉妹染色分体の分離をひき起こす. そのほかにも,コヒーシンはDNA損傷の修復や遺伝子の転写制御に機能することが知られているが,ここではそれらの機能およびがん化との関連について割愛する. 3.染色体の接着制御にかかわるタンパク質の異常とがん分裂酵母を用いた遺伝学的な手法によりコヒーシンが発見された時点で,姉妹染色分体の接着機構と染色体不安定性との関連は示唆されていた4).そののちも,多くのがん細胞においてコヒーシンの発現量の増加あるいは減少が報告された.また,染色体不安定性を示す大腸がん細胞の遺伝子解析においてコヒーシンに関連するタンパク質に変異がみつかり,コヒーシンの発現レベルの低下が染色体の接着の減少とともに染色体不安定性を誘導することが示唆された9).これらの結果は,コヒーシンの異常ががん細胞における染色体不安定性の原因となる可能性を示唆した.さらに決定的な証拠として,コヒーシンのサブユニットSA2の発現レベルの低下および変異がさまざまながん細胞において染色体不安定性の引き金となることが報告された10).SA2はX染色体に遺伝子座をもつため男性の細胞には1コピーしか存在せず,欠失および機能欠損が頻繁に生じる.SA2の機能を失った細胞株では染色体不安定性がみられるが,驚くべきことに,外来的にSA2を発現させるとこの染色体不安定性は解消された.これは,コヒーシンの異常が染色体不安定性の原因となることを強く裏づける実験結果といえる. コヒーシンのサブユニットのほかにも,染色体の接着制御にかかわるタンパク質の異常が染色体不安定性やがん化を促進することが報告されている.さきに述べたように,シュゴシンはM期において染色体の接着を維持するために必須の役割をはたすが,いくつかの大腸がん細胞においてSgo1の発現レベルの異常や遺伝子の変異が報告された11,12).また,Sgo1のヘテロノックアウトマウスにおいてがん化が亢進するという結果が報告されている13).コヒーシンの場合と同様に,Sgo1の機能異常によっても染色体の接着の減少および染色体不安定性が観察されることから,姉妹染色分体のセントロメアにおける接着の減少が染色体不安定性に直結していると考えられる. 4.染色体の接着制御にかかわるタンパク質が促進する染色体パッセンジャー複合体の局在それでは,セントロメアにおける接着の異常はどのようにして染色体不安定性をひき起こすのだろうか? コヒーシンやシュゴシンに変異をもつ細胞では染色体の接着が十分に維持されている状態においても,M期における染色体の整列異常が観察されていることから,姉妹染色分体の接着の維持機構そのものが染色体の整列になんらかの役割をもつことが考えられる.最近の研究結果から,コヒーシンやシュゴシンは,染色体の整列に重要な役割をもつ染色体パッセンジャー複合体(chromosomal passenger complex:CPC)のセントロメアへの局在に対しても重要な役割をもつことにより,染色体の均等な分配に寄与することが明らかになった14,15). 均等な染色体の分配は,姉妹染色分体の動原体が反対の方向から伸びてくるスピンドル微小管により引っ張られること(二方向性接続)により達成される.しかし,スピンドル微小管の動原体への接続は最初はランダムに起こるため,姉妹染色分体が片方に引かれてしまうような一方向性接続も起こりうる.このような誤った接続を感知し修正する役割をはたすのが,M期キナーゼAurora Bを含む染色体パッセンジャー複合体である16)(図4a).染色体パッセンジャー複合体は,Aurora B,INCENP,Survivin,Borealinの4つのタンパク質からなり,姉妹動原体にはさまれたインナーセントロメアとよばれる領域に局在する.Aurora Bの活性はインナーセントロメアを中心とした勾配をもち,一方向性接続のように姉妹動原体のあいだに張力が生じない状況では動原体まで活性が及ぶようになる17).すると,動原体の外側に位置しスピンドル微小管との接続においてインターフェースとしてはたらくKMNネットワークとよばれる動原体タンパク質(Ndc80,Dsn1,KNL1)がリン酸化されるようになる(図4b).これらのタンパク質のリン酸化はスピンドル微小管との親和性を負に制御することが示されており,このリン酸化が引き金となり,誤った接続が解消されるというモデルが提唱されている.実際に,Aurora Bの活性を阻害すると,一方向性接続の増加にともなう染色体の整列異常が著しく観察される.二方向性接続が完了して張力が生じると,姉妹動原体がインナーセントロメアから離れることにより,Aurora Bによる動原体タンパク質のリン酸化レベルは著しく低下させる方向に作用する.また,それにくわえ,張力の生じた動原体にはAurora Bに拮抗するホスファターゼであるPP1やPP2Aが局在し,動原体タンパク質のリン酸化レベルは著しく低下する.このようにして,接着により生み出される張力とAurora Bによる接続の修正機能が協調することにより,効率よく二方向性接続が確立されると考えられている. 図4 Aurora Bによる動原体とスピンドル微小管との接続の修正 (a)Aurora Bは姉妹動原体のあいだのインナーセントロメアに局在する.姉妹動原体が片方の極に由来するスピンドル微小管によりとらえられた場合には姉妹動原体に張力は生じない.このような一方向性接続では,動原体がインナーセントロメアに近い領域に位置しAurora Bのはたらきにより不安定化される.姉妹動原体が両方の極に由来するスピンドル微小管により反対の方向に引っ張られた二方向性接続では,動原体はインナーセントロメアから離れた領域に位置しAurora Bによる不安定化をまぬがれる. (b)Aurora Bは微小管とのインターフェースとなるKMNネットワークとよばれる動原体タンパク質をリン酸化(P)することにより,動原体と微小管との接続を不安定化する.Aurora Bの活性はインナーセントロメアに近い領域ほど高い勾配をもつ.二方向性接続が確立され動原体がインナーセントロメアから離れると,Aurora Bの活性が低下するとともに,ホスファターゼであるPP1やPP2Aが動原体に局在しKMNネットワークは脱リン酸化される.これにより微小管と動原体との接続が安定化される. [Download]  染色体パッセンジャー複合体のインナーセントロメアへの局在はスピンドル微小管の接続における修正機構をはたらかせるうえで必須であるが,その局在化の機構は謎につつまれていた.筆者らの研究室は,コヒーシンがM期キナーゼHaspinの役割をつうじ染色体パッセンジャー複合体の局在を制御することを報告した14)(新着論文レビュー でも掲載).HaspinはヒストンH3の3番目のスレオニン残基をリン酸化するキナーゼであり,M期の細胞においてそのリン酸化はセントロメアにおいて観察される.このリン酸化は染色体パッセンジャー複合体の構成タンパク質のひとつであるSurvivinとの直接の相互作用を介し染色体パッセンジャー複合体をセントロメアへと局在させる役割をもつ.それまで,HaspinがセントロメアにおいてのみヒストンH3の3番目のスレオニン残基をリン酸化する機構は知られていなかった.分裂酵母を用いた研究からHaspinはコヒーシンと直接に結合することが示され,HeLa細胞ではコヒーシンをRNAi法によりノックダウンした細胞においてセントロメアにおけるヒストンリン酸化が染色体の腕部へと拡散するようすが観察された.このことから,M期においてセントロメアに維持されるコヒーシンが,Haspinの機能を介し染色体パッセンジャー複合体の局在を制御することが示された.また,筆者らの研究室は,シュゴシンSgo1,Sgo2のそれぞれが染色体パッセンジャー複合体の構成タンパク質のひとつBorealinと直接に結合し,染色体パッセンジャー複合体をセントロメアへと局在させることを示した15)(新着論文レビュー でも掲載).シュゴシンとBorealinとの相互作用はサイクリンB-CDK1複合体によるBorealinのリン酸化により促進される.このように,姉妹染色分体のセントロメアにおける接着にはたらくコヒーシンおよびシュゴシンは,二方向性接続の確立に必要な染色体パッセンジャー複合体の局在をも制御していることがわかった. 5.インナーセントロメア-シュゴシンネットワークとがん染色体の二方向性接続に必須の役割をもつ染色体パッセンジャー複合体とシュゴシンとの複合体の局在を制御するネットワークは“インナーセントロメア-シュゴシンネットワーク”とよばれる18)(図5).M期キナーゼBub1によりリン酸化されたヒストンH2Aの120番目のスレオニン残基やヘテロクロマチンタンパク質HP1は,シュゴシンの直接の足場となることが知られている19,20).HaspinによるヒストンH3の3番目のスレオニン残基のリン酸化とBub1によるヒストンH2Aの120番目のスレオニン残基のリン酸化は,染色体パッセンジャー複合体とシュゴシンとの複合体をインナーセントロメアに局在させるため必須の役割をはたす2つのヒストンマークであり,インナーセントロメア-シュゴシンネットワークにおいて中心的な役割をはたしている.Bub1の機能不全は二方向性接続の異常をつうじ細胞に染色体不安定性をもたらし,がん化をひき起こすと考えられる.実際に,ヒトのがん細胞においてもBub1の変異が報告されており,Bub1のヘテロノックアウトマウスは染色体不安定性を示す21).また,HP1は多くのがん細胞において発現の低下が観察されている22). 図5 インナーセントロメア-シュゴシンネットワーク M期キナーゼBub1によるヒストンH2Aの120番目のスレオニン残基のリン酸化(P)は,シュゴシンのSGOモチーフとの相互作用を介しシュゴシンを局在化させる.染色体パッセンジャー複合体(CPC)はM期キナーゼHaspinによりリン酸化されたヒストンH3の3番目のスレオニン残基に直接に結合することで局在化が促進される.この2つのヒストンのリン酸化修飾は染色体パッセンジャー複合体とシュゴシンとの複合体の局在を制御するヒストンマークであり,この局在を制御するネットワークをインナーセントロメア-シュゴシンネットワークとよぶ.シュゴシンのコイルドコイル領域にはホスファターゼPP2Aが結合し,セントロメアにおいてコヒーシンを保護する.また,コヒーシンはHaspinの足場になると考えられており,ヒストンH3の3番目のスレオニン残基のリン酸化を促進する.シュゴシンのもつP-V-IモチーフはHP1との相互作用をつうじセントロメアへの局在に寄与する.HP1はSuv39Hによりメチル化(M)されたヒストンH3の9番目のリジン残基を足場とする. [Download] 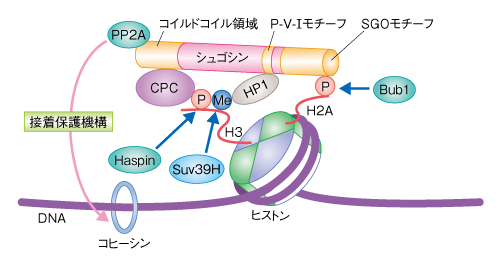 Suv39H1およびそのパラログであるSuv39H2は,染色体においてHP1の足場となるヒストンH3の9番目のリジン残基のメチル化酵素である.Suv39H1とSuv39H2のダブルノックアウトマウスは姉妹染色分体の接着の異常および染色体不安定性を示し腫瘍形成のリスクが高まっていることが報告されている23).また,Suv39H1およびSuv39H2と拮抗する脱メチル化酵素であるJMJD2ファミリータンパク質の過剰発現が,染色体不安定性を示す多くのがん細胞において報告されていることからも24),ヒストンH3の9番目のリジン残基のメチル化の制御は,細胞のがん化において重要な意味をもつと考えられる.JMJD2ファミリータンパク質の過剰発現が染色体不安定性をひき起こす機構については明らかになっていないが,HP1およびシュゴシンの局在性の低下を介している可能性が考えられる. ほかにも最近,がん抑制遺伝子産物として知られるRbは,細胞周期の制御のほか,染色体におけるコヒーシンの局在に機能をはたすことが報告されている25).しかしながら,Rbがどのようにしてコヒーシンの局在化を促進するのか,その分子機構については未解明であり今後の研究が待たれる. おわりに姉妹染色分体の接着の制御機構が破綻することによりひき起こされる細胞のがん化については,最近になり報告があいついではいるが,いまのところ,一般にはあまりなじみのないがん化の経路である.しかしながら,10年以上まえに酵母においてコヒーシンが発見された際に提唱されたがんとの関連は,そののち,動物細胞を用いた解析により支持されることとなった.コヒーシンの保護および染色体パッセンジャー複合体の局在にかかわるインナーセントロメア-シュゴシンネットワークとともに,染色体の接着異常が異数性およびがん化をひき起こすもっとも重要な経路を形成している可能性がでてきている. 文 献
著者プロフィール略歴:2010年 東京大学大学院農学生命科学研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教. 研究テーマ:M期におけるセントロメアの形成の分子基盤. 関心事:染色体不安定性をひき起こす分子機構,実際にからだのなかで起こっている細胞分裂と染色体分配. 渡邊 嘉典(Yoshinori Watanabe) 東京大学分子細胞生物学研究所 教授. 研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/watanabe_lab/ © 2012 丹野悠司・渡邊嘉典 Licensed under CC 表示 2.1 日本 |
| レビュー補足 | - |
| カテゴリ | 分子生物学 |
| タグ | がん, 染色体不安定性, 染色体分配, 細胞分裂 |
| 図1 | 図1 染色体サイクル |
| 図2 | 図2 M期における染色体の動態 |
| 図3 | 図3 姉妹染色分体の接着 |
| 図4 | 図4 Aurora Bによる動原体とスピンドル微小管との接続の修正 |
| 図5 | 図5 インナーセントロメア-シュゴシンネットワーク |
| 図6 | - |
| 図7 | - |
| 図8 | - |
| 図9 | - |
| 図10 | - |
| pdf file | Watanabe-1.e004-PDF.pdf |
| doc file | Watanabe-1.e004.doc |
| txt file | Watanabe-1.e004.txt |